Методы регенерации хрящевой ткани
| Разместил: seregapro | 4 апреля 2014 | Просмотров: 5418 |
Метки: Здоровье, хрящ
Наиболее часто спортсмены покидают спорт из-за травм суставно-связочного аппарата. Его слабое место - хрящ. Проблемы с позвоночником также обусловлены в основном патологией межпозвоночных хрящей.
Можно сказать, что в спортивной травматологии лечение хрящей является заботой № 1. Попробуем более подробно рассмотреть, что же такое хрящ и определить пределы и методы его регенерации...
Хрящевая ткань - одна из разновидностей соединительной ткани, которая выполняет в организме опорные функции. Непременным атрибутом хряща, за исключением суставного, является надхрящница, обеспечивающая его питание и рост. В суставах хрящ обнажен и контактирует непосредственно с внутренней средой сустава - синовиальной жидкостью. Она выполняет роль своеобразной смазки между трущимися поверхностями суставов, покрытых гладким глиаиновым хрящом. Хрящи костей и позвоночника постоянно испытывают как статическую, так и динамическую нагрузки.
Структура хряща позволяет ему испытывать обратимую деформацию и в то же время сохранять способность к обмену веществ и размножению. Главные его компоненты - хрящевые клетки (хондроциты) и внеклеточный матрикс, состоящий из волокон и основного вещества. Причем, большую часть массы хряща составляет именно межклеточное вещество.
Особенностью хряща, по сравнению с другими видами тканей в организме является то, что в нем мало клеток, и они окружены большим количеством межклеточного пространства - матрикса. Хрящ так плохо восстанавливается после повреждений именно потому, что в нем очень мало клеток, способных размножаться и основная часть репарации (восстановления) идет за счет внеклеточного матрикса.
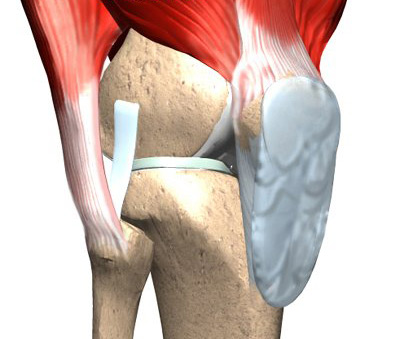
В суставном хряще очень много воды (в хряще головки бедренной кости молодого человека - 75 г на 100 г ткани). Глауроновая кислота помогает матриксу связывать воду, чем и обеспечиваются упругие и эластические свойства ткани.
В гиалиновом хряще, который чаще всего представляет внутрисуставную поверхность, половину всего матрикса составляет коллаген - основной белок соединительной ткани. Только сухожилия и дерма (глубокий слой кожи) превосходят матрикс по насыщенности коллагеном. Наибольшая его концентрация в суставных хрящах сосредоточена в поверхностной зоне.
Коллаген - понятие собирательное, существуют несколько его видов. Разные по химическому составу, все они, тем не менее, состоят из очень крупных молекул, свернутых в тройные спирали. Такое строение волокон делает их очень прочными на скручивание, растяжение и разрыв. Каждая из трех цепей имеет полипептидную структуру.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Если мы проанализируем состав полипептидных цепей любого из трех видов коллагена (у человека их насчитывается именно три), то увидим, что наиболее велик удельный вес аминокислоты глицина. Следом за ним по удельному весу следуют аминокислоты промен (пролин -?) и аланин. Иногда аланин "перевешивает" пролин, а иногда наоборот, пролин по своему удельному весу превосходит аланин.
Основной аминокислотой коллагена является глицин. За ним по процентному содержанию следуют аланин, пролин и валин. У разных хрящей в матриксе преобладают либо коллагеновые, либо эластиновые волокна. Все они переплетены в прочную трехмерную сеть. Коллагеновая (эластиновая) сеть "удерживает" внутри хряща и другие молекулы как механически, так и с помощью электростатических связей.
Считается, что хрящевой матрикс состоит из 3-х основных компонентов:
1) волокнистый коллагеновый каркас, который образует трехмерную сеть переплетений;
2) молекулы протеогликанов, которые заполняют петли волокнистого каркаса;
3) вода, свободно перемещающаяся между переплетениями каркаса и молекулами протеогликанов.
У суставного хряща нет кровеносных сосудов. Он питается диффузно, поглощая питательные вещества из синовиальной жидкости. Коллагеновый каркас является как бы "скелетом" хряща. Он обладает большой упругостью по отношению к силам растяжения и в тоже время оказывает относительно слабое сопротивление нагрузке на сжатие. Поэтому внутрисуставные хрящи (например: мениски и суставные поверхности бедренной и берцовых костей) легко повреждаются при компрессионных (сжимающих) нагрузках и почти никогда при нагрузках на растяжение ("на разрыв").
Протеогликановый компонент матрикса отвечает за способность хряща связывать воду. Она может удаляться за пределы хряща в синовиальную жидкость и возвращаться в него обратно. Именно вода как несжимаемая субстанция обеспечивает достаточную жесткость хряща. Ее перемещения равномерно распределяет внешнюю нагрузку по всему хрящу, в результате чего происходит ослабление внешних нагрузок и обратимость возникающих при нагрузках деформаций.
Коллагеновые хрящи суставов вообще не содержат сосудов. Большая механическая нагрузка на хрящ несовместима с васкуляризацией (сосудистым обеспечением). Обмен в таком хряще осуществляется благодаря перемещению воды между компонентами матрикса. Она содержит все необходимые хрящам метаболиты. Поэтому в них резко замедлены как анаболические, так и катаболические процессы. Отсюда плохое их посттравматическое восстановление, в отличие от хрящей с васкуляризацией.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Кроме гиалинового и эластического хрящей выделяют еще одну группу - волокнистый, или фиброзный хрящ. Фиброз - значит "волокно". Матрикс фиброзного хряща образован коллагеновыми волокнами, однако, по сравнению, скажем, с глиаиновым хрящом пучки коллагеновых волокон более толстые и не имеют структуры трехмерного переплетения. Они ориентированы, в основном, параллельно друг другу. Их направление соответствует векторам сил натяжения и давления. Из фиброзного хряща состоят межпозвонковые диски, отличающиеся большой прочностью. Крупные коллагеновые волокна и их пучки располагаются в межпозвонковых дисках циркулярно. Помимо межпозвонковых дисков волокнистый хрящ находится в местах прикрепления сухожилий к костям или хрящам, а также в сочленении лобковых костей.
Поддержание всей структурной целостности матрикса хряща зависит целиком от хондроцитов. И хотя их масса невелика, они синтезируют, тем не менее, все биополимеры, из которых состоит матрикс - коллаген, эластин, протеогликоны, гликопротеины, и т.д. При удельном весе от 1 до 10% общего объема хрящевой ткани хондроциты обеспечивают образование больших масс матрикса. Они контролируют также все катаболические реакции в хряще.
В чем причина низкой метаболической активности хряща? Только в одном - в малом количестве клеток (1-10%) в единице объема ткани. В пересчете на чистую клеточную массу уровень метаболизма хондроцитов ничуть не меньше, чем у других клеток организма. Особенно низким метаболизмом отличаются суставные хрящи и пульподные ядра межпозвонковых дисков. Именно эти структуры отличаются самым малым количеством хондроцитов (1% от общей массы хряща) и именно они хуже всех других восстанавливаются после повреждений.
Насколько низка метаболическая активность хряща, можно понять из следующего сравнения. Белковый состав печени полностью обновляется за 4(!) дня. Коллаген хрящей обновляется всего лишь на 50% за 10(!) лет. Поэтому становится понятным, что любая травма хрящевой ткани практически неизлечима, если только не принять специальных мер, направленных на увеличение числа хондроцитов, которые сформируют новый матрикс.
Интересно, что матрикс - порождение хондроцитов - живет своей самостоятельной жизнью. Он способен модулировать действие различных гормонов на хондроциты, ослабляя, либо усиливая их действие. Воздействуя на матрикс, можно изменить состояние хондроцитов как в лучшую, так и в худшую сторону. Удаление части матрикса вызывает немедленную интенсификацию биосинтеза недостающих в нем макромолекул. Более того, одновременно усиливается пролиферация (разрастание) хондроцитов. Количественные изменения в матриксе способны вызвать их качественные изменения.
Длительное ограничение движений в суставе (гипсовая иммобилизация и др.) приводит к уменьшению массы хрящей. Причина на удивление проста: в неподвижном суставе отсутствует перемешивание синовиальной жидкости. При этом диффузия молекул в хрящевую ткань замедляется и питание хондроцитов ухудшается. Недостаток прямой компрессивной нагрузки (на сжатие) так же приводит к ухудшению питания хондроцитов. Хрящу нужна хотя бы минимальная компрессионная нагрузка для поддержания нормальной трофики. Чрезмерная нагрузка на растяжение в эксперименте вызывает перерождение хряща с развитием грубых фиброзных волокон.
Очень сложное влияние на состояние внутрисуставных хрящей оказывает синовиальная оболочка. Она может как усиливать анаболизм хрящевой ткани, так и усиливать ее катаболизм. Удаление синовиальной оболочки резко ухудшает трофику хрящей, которая восстанавливается лишь после ее отрастания.
Хондроциты способны и к ауторегуляции. Они синтезируют специальные факторы роста, стимулирующие разрастание соседних хондроцитов. Пока их структура полностью не расшифрована. Известно лишь то, что они имеют полипептидную природу. Все хрящи, но особенно хрящи опорно-двигательного аппарата постоянно подвергаются микротравматизации.
В гиалиновых хрящах суставов уже начиная с 30-летнего возраста обнаруживается фибриляция - разволокнение хрящевой поверхности. При микроскопическом исследовании на поверхности хряща обнаруживаются разломы и расщепления. Расщепление хряща происходит как вертикальном, так и в горизонтальном направлении. При этом местами встречаются скопление клеток хрящевой ткани как ответная реакция организма на разрушение хряща. Иногда отмечается возрастное увеличение (!) толщины суставных хрящей как ответное действие на действия механических (тренировка) факторов. Возрастную эволюцию хрящей коленного сустава многие исследователи отмечают начиная уже с 40-летнего возраста. Наиболее существенное изменение, отмечаемое при старении хряща - это уменьшение содержания воды, что автоматически приводит к снижению его прочности.
Отсюда чрезвычайная сложность его посттравматического лечения. Более того, иногда непросто бывает даже сохранение нормального состояния хрящей в ходе обычного тренировочного процесса. Рост мышечной ткани опережает упрочнение суставно-связочного аппарата и в особенности его хрящевой части. Поэтому, рано или поздно, нагрузки достигают такой величины, которую хрящевая часть опорно-двигательного аппарата уже не может выдержать. В результате возникают "неизбежные" труднозалечиваемые травмы, из-за которых спортсмен иногда расстается со спортом. Самостоятельное восстановление хряща никогда не бывает полным. В лучшем случае хрящ восстанавливается на 50% от исходной величины. Однако это не значит, что дальнейшее его восстановление невозможно. Оно возможно при грамотном фармакологическом воздействии, призванном вызвать, с одной стороны, размножение хондроцитов, а с другой - изменение состояния матрикса хряща. Проблема восстановления хряща многократно усложняется еще и тем, что на месте погибшей хрящевой ткани развивается рубцовая ткань. Она не дает хрящу регенерировать в нужном месте. Компенсаторное разрастание участков хряща по соседству с местом повреждения приводит к его деформации, затрудняя задачу фармакологической стимуляции роста. Впрочем, все эти сложности преодолимы, если деформированный хрящ вначале подвергнуть хирургической коррекции.
Потенциальные возможности регенерации хряща достаточно велики. Он может регенерировать за счет собственного потенциала (размножение хондроцитов и рост матрикса) и, что не менее важно, за счет других видов соединительной ткани, которые имеют общее с ним происхождение. Примыкающие к хрящу ткани обладают способностью к переориентации своих клеток и превращению их в хрящеподобную ткань, которая неплохо справляется со своими функциями. Возьмем для примера самый частый вид повреждений - повреждение внутрисуставного хряща. Источником регенерации являются:
1) сам хрящ;
2) синовиальная оболочка сустава, нарастающая с краев дефекта и превращающаяся в хрящеподобную ткань;
3) костные клетки, которые, не будем забывать, имеют хрящевое происхождение и при необходимости могут трансформироваться "обратно" в ткань, напоминающую по своему строению хрящевую;
4) клетки костного мозга, которые могут служить источником регенерации при глубоких повреждениях хрящей в сочетании с костным повреждением.
Сразу же после травмы наблюдается "взрыв" митоической активности хондроцитов, которые размножаются и формируют новый матрикс. Процесс этот наблюдается в течение 2-х недель после повреждения, однако ремодулирование поверхности хряща длится не менее 6-и месяцев, а полностью прекращается лишь через год. Качество "нового" хряща, конечно же, уступает качеству "старого". Если, например, поврежден гиалиновый внутрисуставный хрящ, то через 3-6 месяцев вырастает регенерат, имеющий характер гиалиново-фиброзного молодого хряща, а через 8-12 месяцев, он уже превращается в типичный фиброзный хрящ с матриксом, состоящим из плотно прилегающих друг к другу коллагеновых волокон.
Все исследователи хрящевой ткани единодушны в одном: хрящ не способен восстановить утраченное только за счет собственных внутренних ресурсов и механизмов. Их хватает максимум на 50% регенерата. Еще некоторый прирост регенерата осуществляется за счет других видов соединительной ткани, о которых мы уже говорили, но о полном 100% восстановлении хряща говорить все равно не приходится. Все это вносит изрядную долю пессимизма в оценку возможности выздоровления после сколько-нибудь серьезной травмы хряща, однако поводы для оптимизма все-таки есть. Достижения фармакологии и трансплантологии на сегодняшний день таковы, что можно говорить о полной компенсации даже очень серьезных хрящевых дефектов, как бы ни было это трудоемко.
В подостром периоде, когда отек мягких тканей и болевой синдром существенно снижены, необходимо позаботиться, чтобы как можно полнее рассосалась поврежденная ткань. С этой целью применяет протеолитические ферменты (трипсин, хелеотрипсин, папаин и др.), которые вводятся в поврежденный участок при помощи электрофореза. Хороший эффект дают глюкокортикоидные гормоны - гидрокортизон, преднизолон и др. Как и протеолитические ферменты они вводятся местно, в пораженную область - будь то межпозвоновый диск или суставы конечностей. Гидрокортизон вводят с помощью ультразвука, а преднизолон - электрофорезом. Иногда вводят глюкокортикоидные гормоны в полости суставов, например, при лечении травм коленного сустава. У него самое сложное строение и лечить его травмы весьма непросто.
Мениски - внутрисуставные хрящи в коленных суставах при повреждениях практически не срастаются. Поэтому, если имеются надрывы или отрывы частей менисков их необходимо как можно раньше удалить. Легче "вырастить" регенерат на месте удаленного мениска (а такой регенерат обязательно вырастает), чем добиться заживления мениска поврежденного. К счастью, в последние годы широкое развитие получила артроскопия, и операции на коленном суставе становятся все более и более щадящими. Артроскоп позволяет с помощью волокнистой оптики заглянуть внутрь сустава, не вскрывая его (проделываются лишь несколько отверстий). Через артроскоп же проводится и оперативное вмешательство. Иногда бывает так, что в результате травмы мениск остается целым, но отрывается от места своего прикрепления. Если раньше такой мениск всегда удаляли, то теперь все больше появляется специалистов, которые пришивают оторванный мениск на место. После освежения краев раны пришитый мениск прирастает на место.
Если при артроскопии обнаруживается разволокнение тех или иных хрящевых поверхностей, то их шлифуют, "скусывают" специальными кусачками волокна и участки деформированного хряща. Если этого не сделать, то последующие меры, принятые для усиления регенерации хрящевой ткани могут привести к росту деформированного хряща и нарушению его опорных функций.
При поверхностных повреждениях можно добиться полного восстановления хряща, применяя сильнодействующие фармакологические средства. За последние сорок лет экспериментальных и клинических работ свою высокую эффективность доказал лишь один единственный препарат - соматотропный гормон (СТГ). Он стимулирует рост хрящевой ткани в 100 раз сильнее, чем введение тестостерона и инсулина. Еще больший эффект оказывает комбинированное введение СТГ и тиреокальцитонина - особого рода гормона щитовидной железы, который усиливает репарацию как костной, так и хрящевой ткани. Исключительная эффективность действия СТГ на репарацию хряща обусловлено тем, что он стимулирует непосредственно деление хондроцитов. Используя СТГ теоретически можно довести количество хондроцитов до любого нужного количества. Они, в свою очередь, восстанавливают матрикс до необходимого объема, синтезируя все его компоненты, начиная с коллагеновых волокон и кончая протеогликанами.
Недостатком СТГ является то, что его нельзя применять местно, вводя непосредственно в зону поражения хрящевой ткани, поскольку действует он опосредованно. СТГ вызывает образование в печени инсулиноподобного фактора роста (ИРФ-1) который и оказывает сильнейший анаболический эффект. Парентеральное (инъекционное) его введение вызывает рост не только поврежденных хрящей, но и нормальных тоже, а это нежелательно, ведь в организме существуют кости, в которых хрящевые зоны роста не закрываются на протяжении всей жизни. Длительное введение больших доз СТГ в сформировавшийся организм может вызвать диспропорции скелета. Хотя следует отметить, что на пораженный хрящ он действует сильнее, и явных деформаций скелета при лечении СТГ в научной литературе не встречается.
В последние годы синтезирована лекарственная формы ИРФ-1, которую все шире применяют инъекционно вместо соматотропина. Поскольку ИРФ-1 действует непосредственно на ткани (в т.ч. и на хрящевую), то возникает заманчивая перспектива использовать его для местного введения (электрофорез, ультразвук и т.д.). Такое применение ИРФ-1 позволило бы локализовать его действие местом пораженного хряща и исключить действие на здоровые хрящи организма.
Неплохое действие на восстановление хряща и окружающего его соединительной ткани оказывают анаболические стероиды (АС). По эффективности они стоят на втором месте после ИРФ-1 и соматотропного гормона, хотя непосредственно деления хондроцитов они не вызывают. Анаболические стероиды, однако, ускоряют физиологическую регенерацию и потенцируют анаболическое действие инсулина и других эндогенных анаболических факторов, блокируют действие катаболических гормонов (глюкокортикоидов). Практическое применение АС в хирургической и травматологической практике доказало их высокую эффективность. Очень жаль, что до сих пор не разработаны лекарственные формы АС для локального применения. Это позволило бы создавать высокие концентрации лекарственного вещества именно в месте повреждения и предотвращать системные (на уровне всего организма) побочные действия. К сожалению, исследования в данной сфере никем не финансируются из-за причисления АС к допинговым средствам в спорте.
Некоторые исследователи в области молекулярной биологии представили очень убедительный материал, доказывающий, что стимуляторы 2-адренергических рецепторов способны симулировать анаболические эффекты соматомединов и, в частности, по отношению к хрящевой ткани. Механизм такого действия не вполне ясен. Не исключено, что просто повышается чувствительность печени к эндогенному соматотропному гормону и возрастает синтез в печени ИРФ-1. Одним из наиболее сильных избирательных стимуляторов 2-адренергических рецепторов является кленбутерол. Этот препарат не обладает гормональными эффектами и, в то же время, оказывает хорошее анаболическое действие. Подобно ИРФ-1 он стимулирует рост хрящевой ткани и может с успехом применяться в посттравматическом восстановительном периоде.
Препаратов, стимулирующих 2-адренорецепторы много, но особо хотелось бы отметить такое старое и проверенное средство как адреналин. Адреналин - гормон мозгового вещества надпочечников даже при длительном курсовом применении не вызывает привыкания. В больших дозах адреналин воздействует в основном на а-адренорецепторы. Происходит сужение сосудов кожи, повышение артериального давления, подъем уровня сахара в крови. Малые дозы адреналина не затрагивают а-адренорецепторов, стимулируют 2-адренорецепторы. Расширяются сосуды мышц, снижаются уровень сахара в крови и артериальное давление. Развивается общее анаболическое действие и, в особенности по отношению к хрящевой ткани. Ежедневное введение малых (именно малых!) доз адреналина хорошо зарекомендовало себя как средство, способствующее регенерации.
Некоторые витамины в больших фармакологических дозировках способны существенно увеличить выброс в кровь эндогенного соматотропина. Пальму первенства здесь держит никотиновая кислота (витамин РР). Внутривенное введение сравнительно небольших доз никотиновой кислоты способно увеличить базальную секрецию СТГ в 2-3 раза. Увеличивает секрецию гормона роста витамин К, только применять его необходимо в умеренных дозах, чтобы не повысить чрезмерно свертываемость крови.
Несмотря на то, что матрикс хрящевой ткани является производным хондроцитов, изменение его состояния может улучшить и их деятельность. Состояние матрикса можно улучшить, применяя большие дозы аскорбиновой кислоты в сочетании с витамином Р. Особенно сильно аскорбиновая кислота влияет на состояние коллагеновых структур. Поэтому ее традиционно используют для усиления синтеза коллагена, особенно в сочетании с глицином и анаболическими стероидами. Применяется также сочетание больших доз аскорбиновой кислоты с лизином, аланином и пролином.
Состояние хрящевого матрикса внутрисуставных хрящей можно временно улучшить с помощью веществ, вводимых в синовиальную жидкость. В последние годы особенно широко используется введение в сустав 15% раствора поливинилпирролидона, где он пребывает приблизительно 5-6 дней, затем процедуру повторяют, иногда несколько раз. Поливинилпирролидон служит своеобразным временным "протезом" внутрисуставной жидкости. Он улучшает трение внутрисуставных поверхностей, временно снимая нагрузку с суставного хряща. В случаях тяжелых, необратимых повреждениях хрящевой ткани используется протезирование, которое по мере развития оперативной техники дает все более обнадеживающие результаты. Уже никого не удивишь протезами межпозвонковых дисков. Делаются небезуспешные попытки протезирования внутрисуставных хрящей (менисков) коленных суставов.
Очень перспективным направлением является введение в поврежденные участки взвеси хондроцитов. Слабая регенерация хрящевой ткани, как мы помним, обусловлена малым числом хрящевых клеток (хондроцитов) на единицу массы хрящевой ткани. Чужеродные хондроциты, будучи введенными, скажем, в полость сустава не вызывают реакции отторжения, т.к. обладают слабой иммунногенной активностью. Они способны размножаться и образовывать новую хрящевую ткань. Применяют взвесь хондроцитов, полученную из хрящей крупного рогатого скота, умерших людей. Наиболее перспективным представляется использование эмбриональных (зародышевых) хрящевых клеток. Они вообще не вызывают иммунного ответа и, размножаясь, вызывают образование новой хрящевой ткани. К сожалению, все работы с зародышевыми клетками носят пока экспериментальный характер и не вошли в широкую практику. Но это - дело недалекого будущего. Проблема репарации хрящевой ткани в скором времени должна быть решена. Для этого уже есть все предпосылки.




